
A mucopolissacaridose (MPS) IV, ou síndrome de Morquio, é um distúrbio progressivo, multissistêmico, de armazenamento lisossômico resultante de uma deficiência das enzimas N-acetilgalactosamina 6-sulfatase ou β-galactosidase que são responsáveis pelo catabolismo dos glicosaminoglicanos (GAGs),2 os quais estão envolvidos na formação dos ossos, cartilagem, pele, tendões e muitos outros tecidos no corpo.3 São reconhecidas duas formas distintas: tipo A (MPS IVA, Morquio A) e tipo B (MPS IVB). Esses tipos diferem quanto à causa genética da doença, mas os sinais e sintomas entre essas formas podem ser semelhantes e presentes no espectro de progressão da doença.4
MPS IV é progressiva, sistêmica e permanente e pode levar a morbidades sistêmicas e a uma expectativa de vida abreviada.1
A reconhecida raridade da doença, a apresentação heterogênea e a variabilidade na progressão da doença fazem com que o diagnóstico seja difícil e a intervenção precoce crucial.1,2 Independentemente do fenótipo, os sintomas podem progredir para dano aos órgãos alvo. Os fatores de risco para morbidade elevada incluem o seguinte4,5:
A maioria dos pacientes com Morquio A não sobrevive após a segunda década de vida, sendo que as causas de óbito frequentes incluem insuficiência respiratória, complicações decorrentes de cirurgia e insuficiência cardíaca.1
Os pacientes com MPS IV, a qual é comumente percebida como uma condição musculoesquelética,1 podem manifestar ou desenvolver uma sintomatologia imprevisível e clinicamente heterogênea, indo muito além das manifestações óbvias.6 A tabela abaixo ilustra os possíveis sinais e sintomas da Morquio A, que podem ser observados isoladamente ou em combinação com outros e devem levantar sua suspeita de Morquio A.
Manifestações progressivas, sistêmicas podem levar a consequências cardiovasculares,1,7-9 pulmonares,1,6,7,10,11 neurológicas,6,12 musculoesqueléticas,1,6 reumatológicas,5,13 oftalmológicas,1,14,15 otorrinolaringológicas,1,16 hepáticas/abdominais13 e dentárias6,17 potencialmente graves. No entanto, diferentemente de outros distúrbios de MPS, os pacientes com MPS IV não apresentam comprometimento cognitivo.
É importante observar que mais de 70% dos pacientes manifestam características esqueléticas incomuns nos 2 a 3 primeiros anos de vida.6 Uma pesquisa recente indicou que aproximadamente 25% dos pacientes com síndrome de Morquio A apresentam-se com um fenótipo não clássico.5
Os pacientes podem apresentar padrões de sinais e sintomas clássicos ou não clássicos. Frequentemente relata-se que pacientes com o fenótipo não clássico têm uma demora significativa até o diagnóstico em relação à manifestação dos sintomas.1
Progressão variável da doença em pacientes com Morquio A18

Independentemente do fenótipo,1 os sintomas podem evoluir para dano aos órgãos em estágio terminal.
O sub-reconhecimento da apresentação não clássica de Morquio A pode levar a diagnósticos tardios ou à ausência de um diagnóstico, com impactos significativos:
Considerações cirúrgicas
A necessidade e a carga cirúrgicas são altas entre pacientes com Morquio A. De acordo com um estudo da história natural de Morquio A, 70% da população (idade média de 14,5 anos) tiveram pelo menos 1 procedimento cirúrgico.7
Incidência de procedimentos cirúrgicos comuns para a população com Morquio A
A necessidade e o histórico cirúrgico dos pacientes devem alertá-lo para a possibilidade de MPS IV.
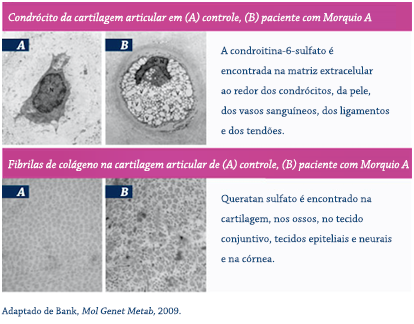
A Morquio A e MPS IVB são causadas por mutações nos genes GALNS e GLB1, que codificam as enzimas N-acetilgalactosamina 6-sulfatase e β-galactosidase, respectivamente.1,25 As deficiências enzimáticas resultantes levam a múltiplas patologias metabólicas, incluindo, mais notavelmente, o acúmulo dos substratos de GAG sulfato de queratina e sulfato de condroitina-6 nos lisossomos no corpo inteiro.1,26
À medida que os lisossomos se acumulam, ocupam uma área cada vez maior do citoplasma, ocultando outras organelas e provocando ruptura da função.27 A atividade enzimática defeituosa na MPS IV leva à disfunção celular, tecidual e do sistema orgânico, que resulta nas morbidades multissistêmicas progressivas, as quais são a marca desse distúrbio.1,6
A pesquisa contínua está transformando o tratamento de pacientes:
Publicadas em 2014, as Diretrizes Internacionais para o Controle e Tratamento da Síndrome de Morquio A estabelecem o padrão de tratamento para Morquio A. Devido à natureza progressiva da doença, essas diretrizes recomendam o início precoce do tratamento com TRE.
Além da TRE, tratamento contínuo por toda a vida e cuidados durante os procedimentos realizados por uma equipe multidisciplinar de tratamento coordenado são componentes essenciais para otimizar os resultados dos pacientes.6 O tratamento de suporte inclui tanto medicações quanto intervenções cirúrgicas, incluindo o seguinte1,7:
Devido à natureza imprevisível e multissistêmica de MPS IVA, avaliação e tratamento regulares, multidisciplinares e abrangentes feitos por uma equipe de tratamento coordenado também são essenciais para identificar sinais de dano aos órgãos e assegurar resultados ideais aos pacientes.1,6 Os médicos podem otimizar o tratamento com a criação de um plano de tratamento personalizado para casa paciente, começando com um cronograma de avaliação completa para cada sistema corporal afetado pela MPS IVA.1
Avaliações recomendadas pelas diretrizes de 2014
Assim que o diagnóstico for confirmado, as avaliações basais devem ser realizadas e a TRE deve ser prontamente iniciada. A TRE pode melhorar significativamente a resistência, conforme medida pelo 6MWT. Uma alteração significativa no 6MWT reflete melhora ou declínio da capacidade funcional dos sistemas cardíaco, respiratório e musculoesquelético e uma modificação na progressão da doença.1,26 Além da TRE, avaliações abrangentes contínuas, tratamento sintomático e intervenções cirúrgicas ,1,7 continuidade do tratamento do contexto pediátrico para adulto é uma consideração crucial para os pacientes e famílias convivendo com a MPS.1,31
Pacientes com MPS IV frequentemente necessitam de intervenção cirúrgica para tratar as complicações multissistêmicas da doença.7 Este tratamento cirúrgico é complicado pela natureza da doença.
Pacientes com MPS IV sofrem de múltiplos fatores que podem aumentar drasticamente o risco cirúrgico e a necessidade de monitoramento32:
Esses fatores complicam os cuidados cirúrgicos e anestésicos, exigem um planejamento prévio e necessitam de técnicas específicas para a doença a fim de aumentar a chance de obter resultados ideais.33
Procedimentos perioperatórios especializados durante a anestesia, como intubação e extubação, e o uso de uma checklist de neuromonitoramento intraoperatório são essenciais para intervenções cirúrgicas bem sucedidas.1,33 Uma equipe cirúrgica integrada consistindo de especialistas em MPS IV é crucial para resultados positivos e duradouros.1
Conforme os pacientes com MPS IV atingem a vida adulta, sua relação com a equipe médica mudará. Para ajudar a conduzir essa transição, planos individuais são necessários para minimizar as interrupções de tratamento, estender o suporte além do escopo de tratamento pediátrico e apoio dos pais e garantir que os pacientes adultos sejam informados sobre como tratar a MPS IV.1,31
Esses planos de transição devem ser adaptados às necessidades específicas de cada paciente, de forma que aqueles que conseguem se cuidar sozinhos tenham as ferramentas necessárias e aqueles que são mais limitados tenham o tratamento e serviços adequados aplicados para apoiá-los. Os planos devem incluir uma avaliação para determinar a capacidade dos pacientes em atingir de forma bem sucedida seus objetivos estabelecidos, bem como conhecimento e capacidade de passar informações sobre sua condição.31
References: 1. Hendriksz CJ, Berger KI, Giugliani R, et al. International guidelines for the management and treatment of Morquio A syndrome. Am J Med Genet Part A. 2014;9999A:1-15. doi:10.1002/ajmg.a.36833. 2. Northover H, Cowie RA, Wraith JE. Mucopolysaccharidosis type IVA (Morquio syndrome): a clinical review. J Inherit Metab Dis. 1996;19(3):357-365. 3. Islam T, Linhardt RJ. Chemistry, biochemistry, and pharmaceutical potentials of glycosaminoglycans and related saccharides. In: Wong C-H, ed. Carbohydrate-based Drug Discovery. Weinheim, Germany: WILEY-VCH Verlag GmbH & Co KGaA; 2003:407-439. 4. Tomatsu S, Montaño AM, Nishioka T, et al. Mutation and polymorphism spectrum of the GALNS gene in mucopolysaccharidosis IVA (Morquio A). Hum Mutat. 2005;26(6):500-512. 5. Montaño AM, Tomatsu S, Gottesman GS, Smith M, Orii T. International Morquio A Registry: clinical manifestation and natural course of Morquio A disease. J Inherit Metab Dis. 2007;30(2):165-174. doi:10.1007/s10545-007-0529-7. 6. Tomatsu S, Montaño AM, Oikawa H, et al. Mucopolysaccharidosis type IVA (Morquio A disease): clinical review and current treatment: a special review. Curr Pharm Biotechnol. 2011;12(6):931-945. doi:1389-2010/11. 7. Harmatz P, Mengel KE, Giugliani R, et al. The Morquio A clinical assessment program: baseline results illustrating progressive, multisystemic clinical impairments in Morquio A subjects. Mol Genet Metab. 2013;109(1):54-61. doi:10.1016/j.ymgme.2013.01.021. 8. John RM, Hunter D, Swanton RH. Echocardiographic abnormalities in type IV mucopolysaccharidosis. Arch Dis Child. 1990;65(7):746-749. 9. Ireland MA, Rowlands DB. Mucopolysaccharidosis type IV as a cause of mitral stenosis in an adult. Br Heart J. 1981;46(1):113-115. 10. Semenza GL, Pyeritz RE. Respiratory complications of mucopolysaccharide storage disorders. Medicine. 1988;67(4):209-219. 11. Pelley CJ, Kwo J, Hess DR. Tracheomalacia in an adult with respiratory failure and Morquio syndrome. Respir Care. 2007;52(3):278-282. 12. Gulati MS, Agin MA. Morquio syndrome: a rehabilitation perspective. J Spinal Cord Med. 1996;19(1):12-16. doi:10.1159/000202621. 13. Holzgreve W, Gröbe H, von Figura K, Kresse H, Beck H, Mattei JF. Morquio syndrome: clinical findings in 11 patients with MPS IVA and 2 patients MPS IVB. Hum Genet. 1981;57(4):360-365. 14. Danes BS. Corneal clouding in the genetic mucopolysaccharidoses: a cell culture study. Clin Genet. 1973;4(1):1-7. 15. Leslie T, Siddiqui MAR, Aitken DA, Kirkness CM, Lee WR, Fern AI. Morquio syndrome: electron microscopic findings [letter]. Br J Ophthalmol. 2005;89(7):917-929. doi:10.1136/bjo.2004.055400. 16. Hendriksz CJ, Harmatz P, Beck M, et al. Review of clinical presentation and diagnosis of mucopolysaccharidosis IVA. Mol Genet Metab. 2013;110:54-64. doi:10.1016/j.ymgme.2013.04.002. 17. Kinirons MJ, Nelson J. Dental findings in mucopolysaccharidosis type IV A (Morquio's disease type A). Oral Surg Oral Med Oral Pathol. 1990;70(2):176-179. 18. Data on file. BioMarin Pharmaceutical Inc. 19. Berger KI, Fagondes SC, Giugliani R, et al. Respiratory and sleep disorders in mucopolysaccharidosis. J Inherit Metab Dis. 2013;36(2):201-210. doi:10.1007/s10545-012-9555-1. 20. Hendriksz C. Improved diagnostic procedures in attenuated mucopolysaccharidosis. Br J Hosp Med. 2011;72(2):91-95. 21. Clarke LA. Pathogenesis of skeletal and connective tissue involvement in the mucopolysaccharidoses: glycosaminoglycan storage is merely the instigator. Rheumatology (Oxford). 2011;50(suppl 5):v13-18. doi:10.1093/rheumatology/ker395. 22. Lehman TJA, Miller N, Norquist B, Underhill L, Keutzer J. Diagnosis of the mucopolysaccharidoses. Rheumatology. 2011;50(suppl 5):v41-v48. 23. Morishita K, Petty RE. Musculoskeletal manifestations of mucopolysaccharidoses. Rheumatology. 2011;50(suppl 5):v19-v25. doi:10.1093/rheumatology/ker397. 24. Muenzer J. Overview of the mucopolysaccharidoses. Rheumatology (Oxford). 2011;50(suppl 5):v4-v12. doi:10.1093/rheumatology/ker394. 25. Wood TC, Harvey K, Beck M, et al. Diagnosing mucopolysaccharidosis IVA. J Inherit Metab Dis. 2013;36(2):293-307. doi:10.1007/s10545-013-9587-1. 26. VIMIZIM [package insert]. Novato, CA: BioMarin Pharmaceutical Inc; 2014. 27. Coutinho MF, Lacerda L, Alves S. Glycosaminoglycan storage disorders: a review. Biochem Res Int. 2012;2012:471325. doi:10.1155/2012/471325. 28. Bank RA, Groener JEM, van Gemund JJ, et al. Deficiency in N-acetylgalactosamine-6-sulfate sulfatase results in collagen perturbations in cartilage of Morquio syndrome A patients. Mol Genet Metab. 2009;97(3):196-201. doi:10.1016/j.ymgme.2009.03.008. 29. Monzon ME, Casalino-Matsuda SM, Forteza RM. Identification of glycosaminoglycans in human airway secretions. Am J Respir Cell Mol Biol. 2006;34(2):135-141. doi:10.1165/rcmb.2005-0256OC. 30. Harmatz P, Mengel KE, Giugliani R, et al. Longitudinal analysis of endurance and respiratory function from a natural history study of Morquio A syndrome. Mol Genet Metab. 2015;114(2):186-194. doi:10.1016/j.ymgme.2014.10.015. 31. American Academy of Pediatrics, American Academy of Family Physicians, American College of Physicians, Transitions Clinical Report Authoring Group, Cooley WC, Sagerman PJ. Supporting the health care transition from adolescence to adulthood in the medical home. Pediatrics. 2011;128(1):182-200. doi:10.1542/peds.2011-0969. 32. Walker R, Belani KG, Braunlin EA, et al. Anaesthesia and airway management in mucopolysaccharidosis. J Inherit Metab Dis. 2013;36(2):211-219. doi:10.1007/s10545-012-9563-1. 33. Theroux MC, Nerker T, Ditro C, Mackenzie WG. Anesthetic care and perioperative complications of children with Morquio syndrome. Paediatr Anaesth. 2012;22(9):901-907. doi:10.1111/j.1460-9592.2012.03904.x.