
A evidência clínica confirmatória, resultante de estudos em irmãos, sugere que a intervenção precoce proporciona diversas oportunidades de melhorar os resultados dos pacientes por meio do controle específico da doença e do rápido início da TRE, se disponível.1-6
A TRE, de início precoce ou mais tardio, demonstrou melhorar os principais parâmetros clínicos, como medidas de resistência e pulmonares, que são essenciais para a qualidade de vida, a manutenção da deambulação e a realização de atividades cotidianas.7,8
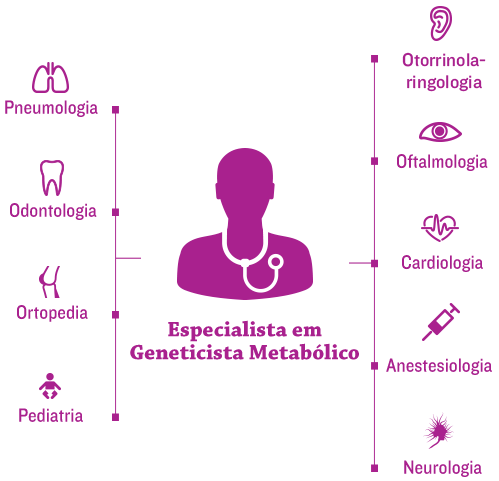
A nova era de tratamento de doenças genéticas complexas e progressivas, como os distúrbios da mucopolissacaridose (MPS), concentra-se na coordenação eficiente da equipe de tratamento de cada paciente no medical home [cuidados médicos centrados no paciente].1
Geneticistas e/ou especialistas em metabolismo costumam estar no centro da equipe médica, ajudando a coordenar o tratamento multidisciplinar e um planejamento de tratamento individualizado.2,3
Em virtude da alta carga cirúrgica dos pacientes com MPS, que é complicada pela natureza sistêmica da doença, anestesiologistas e a equipe de tratamento cirúrgico são membros essenciais da equipe médica multidisciplinar.4,5
Em pacientes com distúrbios da MPS, os benefícios do tratamento coordenado podem melhorar muitos aspectos do quadro do paciente, e da família, a longo prazo.3,6

Muitas MPS possuem diretrizes disponíveis sobre o tratamento e recomendações consensuais específicas para cada especialidade referente ao tratamento da MPS ao longo da vida. No geral, essas diretrizes recomendam3,6:
Avaliações iniciais e contínuas de uma equipe de tratamento coordenado podem melhorar os resultados dos pacientes e podem ajudar a prevenir danos irreversíveis.6
Os efeitos esqueléticos e multissistêmicos da MPS aumentam o risco de morbidade e mortalidade perioperatória, fazendo com que avaliação e monitoramento contínuos sejam essenciais para reduzir o risco de complicações cirúrgicas e anestésicas.5,8 Obstrução das vias aéreas e edema pulmonar estão entre as complicações anestésicas mais significativas, às vezes exigindo traqueostomia ou reintubação de emergência, que podem ser muito difíceis.5
Os pacientes com MPS correm risco elevado de complicações decorrentes da sedação anestésica e do procedimento. Quando possível, anestesia geral deve ser evitada e, quando necessária, administrada somente por anestesiologistas experientes.8,9
O risco de procedimento associado à sedação e anestesia necessárias é uma consideração crucial na seleção da modalidade de exame por imagem para avaliação do comprometimento espinhal.8
Para anestesiologistas responsáveis pelos cuidados anestésicos em pacientes com MPS, deve-se levar em consideração as complicações sistêmicas específicas apresentadas pelos diferentes tipos de MPS, em especial compressão da medula espinhal e obstrução das vias aéreas.8
A preparação para o risco cirúrgico e anestésico em pacientes com MPS requer uma equipe de tratamento multidisciplinar experiente, composta por anestesiologia, cardiologia, pneumologia e otorrinolaringologia.5
Os fatores de risco anestésicos incluem os itens destacados na figura abaixo:
As considerações dos cuidados operatórios entre uma equipe coordenada é crucial para reduzir resultados cirúrgicos negativos.5 A tabela abaixo ilustra essas considerações:
O risco anestésico em pacientes com MPS é considerado alto por muitos motivos, incluindo anormalidades das vias aéreas, deformidades ortopédicas, predisposição pulmonar e comprometimento cardíaco e neurológico.9 Vale notar que determinadas MPS podem representar risco maior que outros, conforme observado na tabela abaixo:
O subtipo e a gravidade da MPS são indicadores importantes do risco anestésico e devem ser levados em consideração antes da cirurgia. O risco cirúrgico é mais elevado para as MPSs I, II, IV e VI, que apresentam taxa de mortalidade global de 20%.9
A frequência das avaliações e o envolvimento de especialistas específicos variam entre os diferentes tipos de MPS. Para pacientes com doenças da MPS associadas a complicações cognitivas e neurodegenerativas primárias, como as MPSs I, II e III, recomendam-se avaliações neurocomportamentais e psiquiátricas adicionais e regulares.6,12,13
Além das avaliações específicas da especialidade que devem ser feitas para facilitar resultados positivos de longa duração para pacientes com MPS, medidas importantes podem ser tomadas pelo médico coordenador, geralmente o geneticista e/ou especialista em metabolismo, em relação à saúde geral. Seu papel na educação de outros profissionais da saúde (ex.: dentistas, fisioterapeutas, pediatras, médicos de família) e famílias sobre a doença e as estratégias de tratamento geral é essencial e deve incluir3:
Avaliações específicas por especialidade, bem como exames físicos de rotina e intervenções de saúde geral, devem seguir as diretrizes recomendadas, que podem variar entre os subtipos de MPS.3
Melhorias no tratamento de distúrbios da MPS contribuem para resultados de longa duração para pacientes, necessitando de novas abordagens para o tratamento vitalício.
À medida que os pacientes envelhecem, alguns podem começar a administrar seu tratamento, tornando crucial a orientação médica na transição para o contexto adulto.3 Os médicos devem assegurar:
A transição do tratamento pediátrico para o adulto e o tratamento adulto a longo prazo são áreas críticas para serem consideradas no planejamento do tratamento para pacientes adolescentes e adultos.3 As considerações de tratamento a longo prazo são melhor abordadas em um centro com experiência considerável em MPS e requerem coordenação cuidadosa entre as especialidades.3,15 As questões a longo prazo incluem, mas não se limitam a:
O tratamento de longa duração de distúrbios da MPS —incluindo avaliações contínuas e estratégia de transição do tratamento pediátrico para adulto específica do centro— pode levar à melhoria sustentada da qualidade de vida e a um futuro melhor para seus pacientes.3,15-17
Uma vez que as manifestações clínicas dos distúrbios da mucopolissacaridose (MPS) são multissistêmicas, é necessária uma abordagem multidisciplinar específica ao paciente para reconhecer e tratar as complicações de maneira proativa. A administração de anestesia deve ser realizada somente em centros especializados, por anestesiologistas experientes e uma equipe capacitada. A indicação para cirurgia deve ser feita somente depois de consultar o anestesiologista, que tem o dever de discutir os riscos e benefícios com os pacientes e sua família.1
Os pacientes com distúrbios de MPS costumam passar por uma série de intervenções cirúrgicas ao longo da vida. Um estudo do curso natural, que avaliou uma coorte de 325 pacientes com Morquio A (MPS IVA), constatou que mais de 70% dos deles tinham sido submetidos a, pelo menos, um procedimento cirúrgico.2

Os pacientes com MPS apresentam uma alta taxa de mortalidade perioperatória devido a múltiplos fatores, incluindo obstrução das vias aéreas superiores e inferiores, instabilidade da coluna cervical, comprometimento respiratório, morbidades cardiovasculares e infecções frequentes.2-4 Por exemplo, complicações cirúrgicas resultaram em uma taxa de mortalidade de 11% em pacientes com Morquio A (n=27).5
Criar um planejamento cirúrgico é essencial e envolve uma equipe multidisciplinar de especialistas que também têm, idealmente, experiência no tratamento de pacientes com MPS.3
Devido ao elevado risco de complicações cirúrgicas e anestésicas, é essencial conhecer as melhores práticas no preparo cirúrgico e cuidados perioperatórios específicos à MPS. O preparo pré-operatório padrão é insuficiente e ineficaz para pacientes com MPS. Uma avaliação completa do caso deve ser realizada especificamente para cada paciente, a fim de planejar e executar os procedimentos que requerem anestesia de forma bem sucedida.1
Monitoramento pós-operatório e uma nova avaliação completa são necessários, mesmo se os pacientes mostrarem a manutenção da melhora após o primeiro ano de cirurgia, uma vez que uma deposição adicional de glicosaminoglicanos (GAG) pode ter alterado a anatomia das vias aéreas e a função cardíaca e pulmonar.1
Uma avaliação pré-operatória exige uma variedade de análises1:
A anestesia geral é perigosa e deve ser evitada na maioria das vezes; anestesia local com bloqueio periférico é preferível sempre que possível. Além disso, a fim de reduzir os riscos associados à exposição a múltiplos anestésicos, aconselha-se combinar duas ou mais intervenções diagnósticas/cirúrgicas durante um episódio de anestesia.1
O tratamento pós-operatório inclui profilaxia com esteroides para reduzir edemas, tratamento padrão para pacientes com obstrução das vias aéreas superiores (pressão positiva bilateral nas vias aéreas, pressão positiva contínua nas vias aéreas) e monitoramento contínuo da função respiratória e cardíaca.1
Quando cirurgia de emergência é necessária, devem ser seguidas as diretrizes usadas para pacientes com suspeita de lesão da coluna cervical.1
A avaliação do risco cirúrgico e monitoramento perioperatório são componentes fundamentais de um plano cirúrgico personalizado e podem reduzir os riscos de resultados cirúrgicos negativos e a mortalidade em pacientes com MPS.3,9,10
References: 1. McGill JJ, Inwood AC, Coman DJ, et al. Enzyme replacement therapy for mucopolysaccharidosis VI from 8 weeks of age—a sibling control study. Clin Genet. 2010;77(5):492-498. doi:10.1111/j.1399-0004.2009.01324.x. 2. Furujo M, Kubo T, Kosuga M, Okuyama T. Enzyme replacement therapy attenuates disease progression in two Japanese siblings with mucopolysaccharidosis type VI. Mol Genet Metab. 2011;104(4):597-602. doi:10.1016/j.ymgme.2011.08.029. 3. Clarke LA. Pathogenesis of skeletal and connective tissue involvement in the mucopolysaccharidoses: glycosaminoglycan storage is merely the instigator. Rheumatology (Oxford). 2011;50(suppl 5):v13-18. 4. Lehman TJA, Miller N, Norquist B, Underhill L, Keutzer J. Diagnosis of the mucopolysaccharidoses. Rheumatology. 2011;50(suppl 5):v41-v48. 5. Morishita K, Petty RE. Musculoskeletal manifestations of mucopolysaccharidoses. Rheumatology. 2011;50(suppl 5):v19-v25. doi:10.1093/rheumatology/ker397. 6. Muenzer J, Beck M, Eng CM, et al. Long-term, open-labeled extension study of idursulfase in the treatment of Hunter syndrome. Genet Med. 2011;13(2):95-101. doi:10.1097/GIM.0b013e3181fea459. 7. Hendriksz C. Improved diagnostic procedures in attenuated mucopolysaccharidosis. Br J Hosp Med. 2011;72(2):91-95. 8. Muenzer J. Early initiation of enzyme replacement therapy for the mucopolysaccharidoses. Mol Genet Metab. 2014;111(2):63-72. doi:10.1016/j.ymgme.2013.11.015. 9. Hendriksz CJ, Berger KI, Giugliani R, et al. International guidelines for the management and treatment of Morquio A syndrome. Am J Med Genet Part A. 2014;9999A:1-15. doi:10.1002/ajmg.a.36833. 10. Bagewadi S, Roberts J, Mercer J, Jones S, Stephenson J, Wraith JE. Home treatment with Elaprase® and Naglazyme® is safe in patients with mucopolysaccharidoses types II and VI, respectively. J Inherit Metab Dis. 2008;31(6):733-737. doi:10.1007/s10545-008-0980-0. 11. BioMarin Pharmaceutical Inc. VIMIZIM Web site. http://www.vimizim.com/. Accessed December 21, 2015. 12. BioMarin Pharmaceutical Inc. Naglazyme Web site. http://www.naglazyme.com/. Accessed December 21, 2015. 13. Muenzer J, Wraith JE, Clarke LA, International Consensus Panel on the Management and Treatment of Mucopolysaccharidosis I. Mucopolysaccharidosis I: management and treatment guidelines. Pediatrics. 2009;123(1):19-29. doi:10.1542/peds.2008-0416.
References: 1. Agency for Healthcare Research and Quality. Defining the PCMH. https://pcmh.ahrq.gov/page/defining-pcmh. Accessed December 15, 2015. 2. Muenzer J. The mucopolysaccharidoses: a heterogeneous group of disorders with variable pediatric presentations. J Pediatr. 2004;144(suppl 5):S27-S34. 3. Hendriksz CJ, Berger KI, Giugliani R, et al. International guidelines for the management and treatment of Morquio A syndrome. Am J Med Genet Part A. 2014;9999A:1-15. doi:10.1002/ajmg.a.36833. 4. Harmatz P, Mengel KE, Giugliani R, et al. The Morquio A clinical assessment program: baseline results illustrating progressive, multisystemic clinical impairments in Morquio A subjects. Mol Genet Metab. 2013;109(1):54-61. doi:10.1016/j.ymgme.2013.01.021. 5. Walker R, Belani KG, Braunlin EA, et al. Anaesthesia and airway management in mucopolysaccharidosis. J Inherit Metab Dis. 2013;36(2):211-219. doi:10.1007/s10545-012-9563-1. 6. Muenzer J, Wraith JE, Clarke LA, International Consensus Panel on the Management and Treatment of Mucopolysaccharidosis I. Mucopolysaccharidosis I: management and treatment guidelines. Pediatrics. 2009;123(1):19-29. doi:10.1542/peds.2008-0416. 7. Vitale MG, Skaggs DL, Pace GI, et al. Delphi Consensus Report: Best practices in intraoperative neuromonitoring in spine deformity surgery: development of an intraoperative checklist to optimize response. Spine Deformity. 2014;2(5):333-339. doi:10.1016/j.jspd.2014.05.003. 8. Solanki GA, Martin KW, Theroux MC, et al. Spinal involvement in mucopolysaccharidosis IVA (Morquio-Brailsford or Morquio A syndrome): presentation, diagnosis and management. J Inherit Metab Dis. 2013;36(2):339-355. doi:10.1007/s10545-013-9586-2. 9. Spinello CM, Novello LM, Pitino S, et al. Anesthetic management in mucopolysaccharidoses. ISRN Anesthesiol. 2013;2013:1-10. doi:10.1155/2013/791983. 10. Theroux MC, Nerker T, Ditro C, Mackenzie WG. Anesthetic care and perioperative complications of children with Morquio syndrome. Paediatr Anaesth. 2012;22(9):901-907. doi:10.1111/j.1460-9592.2012.03904.x. 11. Solanki GA, Alden TD, Burton BK, et al. A multinational, multidisciplinary consensus for the diagnosis and management of spinal cord compression among patients with mucopolysaccharidosis VI. Mol Genet Metab. 2012;107:15-24. doi:10.1016/j.ymgme.2012.07.018. 12. Neufeld EF, Muenzer J. The mucopolysaccharidoses. In: Scriver CR, Beaudet AL, Sly WS, Valle D, eds. The Metabolic and Molecular Bases of Inherited Disease. Vol 3. 8th ed. New York: McGraw-Hill; 2002:2465-2494. 13. Scarpa M, Almassy Z, Beck M, et al. Mucopolysaccharidosis type II: European recommendations for the diagnosis and multidisciplinary management of a rare disease. Orphanet J Rare Dis. 2011;6:72. doi:10.1186/1750-1172-6-72. 14. James A, Hendriksz CJ, Addison O. The oral health needs of children, adolescents and young adults affected by a mucopolysaccharide disorder. JIMD Rep. 2012;2:51-58. doi:10.1007/8904_2011_46. 15. Coutinho MF, Lacerda L, Alves S. Glycosaminoglycan storage disorders: a review. Biochem Res Int. 2012;2012:471325. doi:10.1155/2012/471325. 16. Kakkis ED, Neufeld EF. The mucopolysaccharidoses. In: Berg BO, ed. Principles of child neurology. New York, NY: McGraw-Hill; 1996:1141-1166. 17. Lehman TJA, Miller N, Norquist B, Underhill L, Keutzer J. Diagnosis of the mucopolysaccharidoses. Rheumatology. 2011;50(suppl 5):v41-v48.
References: 1. Spinello CM, Novello LM, Pitino S, et al. Anesthetic management in mucopolysaccharidoses. ISRN Anesthesiol. 2013;2013:1-10. doi:10.1155/2013/791983. 2. Harmatz P, Mengel KE, Giugliani R, et al. The Morquio A clinical assessment program: baseline results illustrating progressive, multisystemic clinical impairments in Morquio A subjects. Mol Genet Metab. 2013;109(1):54-61. doi:10.1016/j.ymgme.2013.01.021. 3. Walker R, Belani KG, Braunlin EA, et al. Anaesthesia and airway management in mucopolysaccharidosis. J Inherit Metab Dis. 2013;36(2):211-219. doi:10.1007/s10545-012-9563-1. 4. Hendriksz CJ, Berger KI, Giugliani R, et al. International guidelines for the management and treatment of Morquio A syndrome. Am J Med Genet Part A. 2014;9999A:1-15. doi:10.1002/ajmg.a.36833. 5. Lavery C, Hendriksz C. Mortality in patients with Morquio syndrome A. J Inherit Metab Dis Rep. 2015;15:59-66. doi:10.1007/8904_2014_298. 6. Theroux MC, Nerker T, Ditro C, Mackenzie WG. Anesthetic care and perioperative complications of children with Morquio syndrome. Paediatr Anaesth. 2012;22(9):901-907. doi:10.1111/j.1460-9592.2012.03904.x. 7. Muenzer J. The mucopolysaccharidoses: a heterogeneous group of disorders with variable pediatric presentations. J Pediatr. 2004;144(suppl 5):S27-S34. 8. Scarpa M, Almassy Z, Beck M, et al. Mucopolysaccharidosis type II: European recommendations for the diagnosis and multidisciplinary management of a rare disease. Orphanet J Rare Dis. 2011;6:72. doi:10.1186/1750-1172-6-72. 9. Solanki GA, Martin KW, Theroux MC, et al. Spinal involvement in mucopolysaccharidosis IVA (Morquio-Brailsford or Morquio A syndrome): presentation, diagnosis and management. J Inherit Metab Dis. 2013;36(2):339-355. doi:10.1007/s10545-013-9586-2. 10. Vitale MG, Skaggs DL, Pace GI, et al. Delphi Consensus Report: Best practices in intraoperative neuromonitoring in spine deformity surgery: development of an intraoperative checklist to optimize response. Spine Deformity. 2014;2(5):333-339. doi:10.1016/j.jspd.2014.05.003.